Lungenembolie
Die Lungenembolie (LE) ist eine potenziell lebensbedrohliche Erkrankung, die durch den Verschluss einer oder mehrerer Lungenarterien durch ein embolisches Material, meist ein Blutgerinnsel, verursacht wird. Sie stellt eine häufige Komplikation der tiefen Venenthrombose (TVT) dar und ist ein bedeutender Grund für Morbidität und Mortalität weltweit.
Definition
Die Lungenembolie (LE) ist eine potenziell lebensbedrohliche Erkrankung, bei der ein Blutgerinnsel, meist aus den tiefen Venen der Beine, in die Lungenarterien wandert und diese blockiert. Sie führt zu plötzlicher Atemnot, Brustschmerzen und kann bei schwerem Verlauf zum kardiovaskulären Kollaps und Tod führen. Eine rasche Diagnose und Behandlung sind entscheidend.
Ätiologie
Die häufigste Ursache einer Lungenembolie ist eine tiefe Venenthrombose, bei der sich ein Blutgerinnsel in den tiefen Venen der unteren Extremitäten oder des Beckens bildet und in die Lungenarterien embolisiert. Weitere Ursachen können Luftembolien, Fettembolien (z.B. nach Knochenbrüchen), Fruchtwasserembolien oder Tumorzellembolien sein.
Man unterscheidet mehrere Arten von Lungenembolien, die sich anhand der Art und Herkunft des eingeschwemmten Materials unterscheiden lassen:
- Thrombembolie
- Dies ist die häufigste Form der Lungenembolie und wird durch Blutgerinnsel verursacht.
- Septische Embolie
- Diese entsteht durch Bakterien oder andere infektiöse Materialien, die in die Lunge gelangen.
- Knochenmarksembolie
- Hierbei handelt es sich um das Einschwemmen von Knochenmarkpartikeln in die Lunge.
- Fettembolie
- Diese Form tritt auf, wenn Fettpartikel, meist nach Knochenbrüchen, in den Blutkreislauf gelangen und die Lunge erreichen.
- Luftembolie
- Luftblasen, die in die Blutbahn eindringen, können diese Art der Embolie verursachen.
- Tumorembolie
- Tumorzellen, die sich lösen und in die Lunge gelangen, führen zu dieser Form der Embolie.
- Embolie mit Fremdmaterial
- Hierbei handelt es sich um das Einschwemmen von Fremdmaterialien, wie zum Beispiel medizinischen Geräten oder Substanzen, in die Lunge.
Jede dieser Formen kann unterschiedliche Ursachen und Auswirkungen haben, was ihre Diagnose und Behandlung komplex macht.
Risikofaktoren
Risikofaktoren für die Entwicklung einer Lungenembolie umfassen:
- Immobilisation
➜ Langstreckenflüge, längere Bettlägerigkeit, Gipsverbände. - Chirurgische Eingriffe
➜ Besonders orthopädische und gynäkologische Operationen. - Malignome
➜ Erhöhte Thromboseneigung bei Krebspatienten. - Schwangerschaft und Wochenbett
➜ Hormonelle Veränderungen und Druck des Fötus auf Beckenvenen. - Thrombophilien
➜ Angeborene oder erworbene Störungen der Blutgerinnung (z.B. Faktor-V-Leiden-Mutation, Antiphospholipid-Syndrom). - Hormontherapie
➜ Einnahme oraler Kontrazeptiva oder Hormonersatztherapie.
Einteilung
Die Lungenembolie (LE) kann nach dem zeitlichen Verlauf in zwei Hauptkategorien eingeteilt werden: akute Lungenembolie und chronische Lungenembolie. Diese Einteilung hilft, die Pathophysiologie, klinische Präsentation und therapeutischen Ansätze besser zu verstehen und zu unterscheiden
Akute Lungenembolie
Definition: Die akute Lungenembolie tritt plötzlich auf und führt innerhalb von Minuten bis Tagen zu Symptomen und klinischen Zeichen.
Klinische Merkmale:
- Plötzliche Dyspnoe
➜ Atemnot, die plötzlich beginnt und schnell zunimmt. - Brustschmerzen
➜ Oft pleuritisch, verstärkt durch Atmung und Husten. - Hämoptyse
➜ Bluthusten, allerdings weniger häufig. - Synkope
➜ Plötzlicher Bewusstseinsverlust durch kardiovaskulären Kollaps. - Tachykardie und Tachypnoe
➜ Schnelle Herz- und Atemfrequenz. - Hypoxämie
➜ Niedriger Sauerstoffgehalt im Blut.
Chronische Lungenembolie
Definition: Die chronische Lungenembolie entwickelt sich über Monate bis Jahre und resultiert häufig aus wiederholten, unvollständig resorbierten Embolien, die zu einer persistierenden pulmonalen Hypertonie führen können.
Klinische Merkmale:
- Langsam fortschreitende Dyspnoe
➜ Atemnot, die sich schleichend verschlimmert. - Belastungsdyspnoe
➜ Atemnot bei körperlicher Anstrengung. - Rechtsherzinsuffizienz
➜ Zeichen wie periphere Ödeme, Aszites, Hepatomegalie. - Fatigue und Schwäche
➜ Allgemeines Gefühl der Schwäche und Müdigkeit. - Hämoptyse
➜ Kann bei Komplikationen auftreten, ist jedoch selten.
Pathophysiologie
Die Pathophysiologie der Lungenembolie (LE) ist komplex und umfasst eine Reihe von Ereignissen, die zur Obstruktion der Lungenarterien und den damit verbundenen klinischen Manifestationen führen. Diese Ereignisse lassen sich in hämodynamische, respiratorische und zelluläre Reaktionen unterteilen, die zusammen das klinische Bild der Lungenembolie prägen.
Hämodynamische Veränderungen
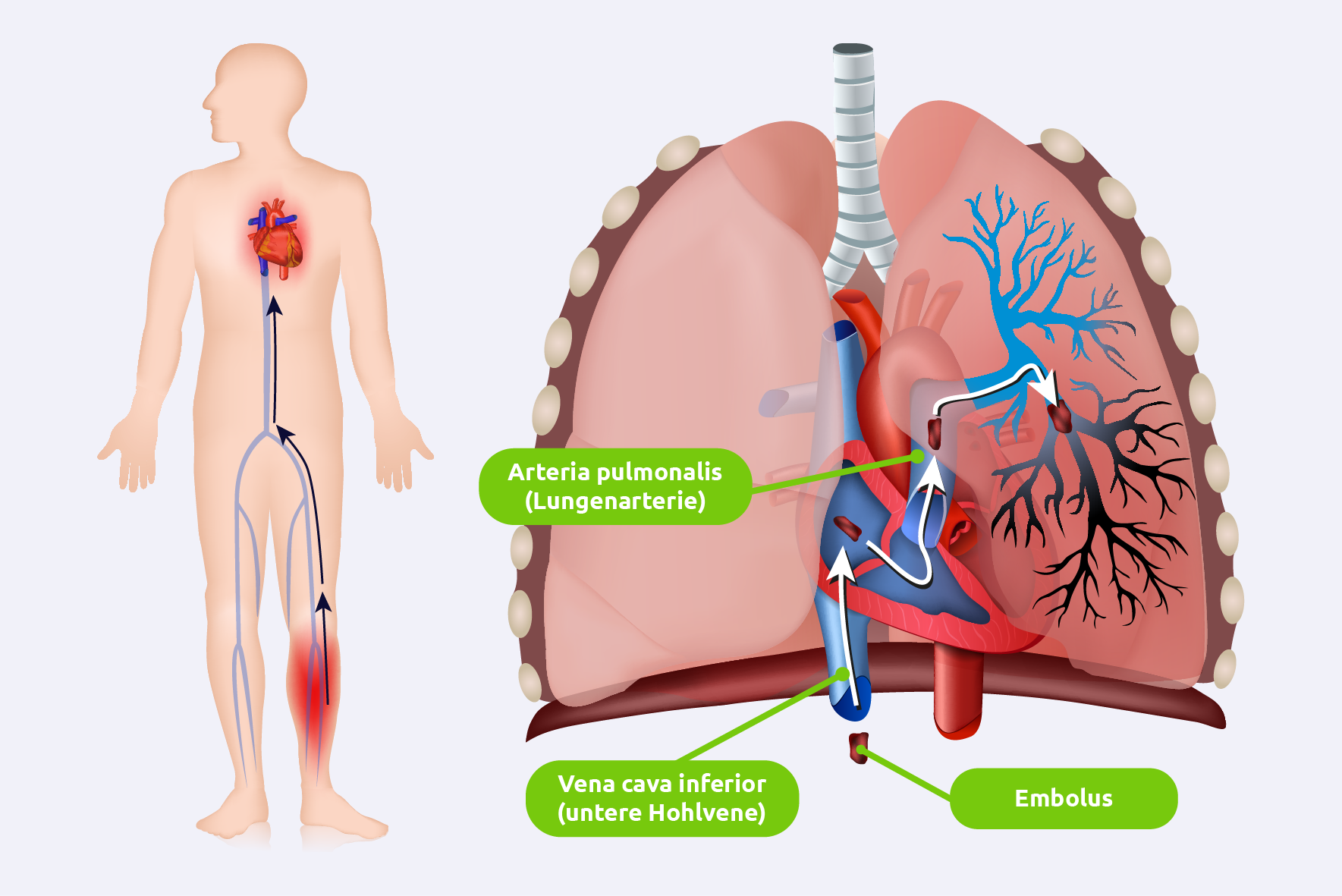
Mechanische Obstruktion
- Ein Thrombus, der meist aus den tiefen Venen der unteren Extremitäten stammt, gelangt über den venösen Kreislauf und die Vena cava inferior (untere Hohlvene) in die rechte Herzhälfte und von dort in die Lungenarterien. Die Größe und Anzahl der Emboli bestimmen das Ausmaß der Obstruktion.
- Größere Emboli können Haupt- oder Segmentarterien verschließen, während kleinere Emboli in die peripheren Lungenarterien gelangen.
Erhöhter pulmonaler Gefäßwiderstand
- Die Obstruktion der Lungenarterien führt zu einem Anstieg des pulmonalen Gefäßwiderstands.
- Zusätzlich zur mechanischen Blockade tragen die Freisetzung von vasoaktiven Substanzen wie Thromboxan A2 und Serotonin aus den Thrombozyten zur Vasokonstriktion bei.
Rechtsherzbelastung
- Der erhöhte Widerstand in den Lungengefäßen erhöht den Druck in der rechten Herzkammer, was zu einer akuten Dilatation und Dysfunktion des rechten Ventrikels führen kann.
- Bei massiver Embolie kann dies zu einem akuten Rechtsherzversagen führen, das als eine der Hauptursachen für den plötzlichen Tod bei LE gilt.
Respiratorische Veränderungen
Ventilations-Perfusions-Ungleichgewicht
- Eine LE führt zu einem Missverhältnis zwischen der Ventilation (Belüftung) und Perfusion (Durchblutung) der Lunge.
- Die betroffenen Lungenareale werden weiterhin belüftet, aber nicht mehr durchblutet, was zu einer ineffizienten Sauerstoffaufnahme führt.
Totraumventilation
- Der Anteil der Lunge, der belüftet aber nicht durchblutet wird, vergrößert sich (physiologischer Totraum).
- Dies führt zu einer ineffektiven Gasaustauschfläche und trägt zur Hypoxämie bei.
Hypoxämie und Hyperkapnie
- Hypoxämie entsteht aufgrund des verminderten Gasaustauschs und der möglichen Hypoventilation durch Schmerz und Angst.
- In schwerwiegenden Fällen kann eine Hyperkapnie (erhöhter CO2-Gehalt im Blut) auftreten, wenn die alveoläre Ventilation nicht ausreicht, um das CO2 zu eliminieren.
Zelluläre und biochemische Reaktionen
Freisetzung von Mediatoren
- Der Thrombus führt zur Aktivierung von Thrombozyten und zur Freisetzung von Mediatoren wie Thromboxan A2, Serotonin und Endothelin.
- Diese Mediatoren verursachen eine Vasokonstriktion und tragen zur pulmonalen Hypertonie bei.
Entzündungsreaktion
- Die Embolisation führt zu einer lokalen und systemischen Entzündungsreaktion.
- Zytokine wie Interleukin-6 (IL-6) und Tumornekrosefaktor-alpha (TNF-alpha) werden freigesetzt und tragen zur Endothelschädigung und weiteren Vasokonstriktion bei.
Endotheliale Dysfunktion
- Der Kontakt des Thrombus mit dem Endothel der Lungenarterien führt zu einer endothelialen Dysfunktion.
- Dies begünstigt eine Thrombose und verschlimmert die Vasokonstriktion und die Hypoxämie.
Pathophysiologische Mechanismen im Überblick
Akute Phase
- Die plötzliche Obstruktion der Lungenarterien führt zu einer sofortigen Erhöhung des pulmonalen Gefäßwiderstands und einer Belastung des rechten Herzens.
- Mediatoren werden freigesetzt, die eine Vasokonstriktion und eine Entzündungsreaktion hervorrufen.
Kompensationsmechanismen
- Der Körper versucht, den erhöhten Widerstand durch Erhöhung der Herzfrequenz und Kontraktilität des rechten Ventrikels zu kompensieren.
- Gleichzeitig wird die Produktion von vasodilatatorischen Substanzen wie Stickstoffmonoxid (NO) und Prostazyklin gesteigert, um die Vasokonstriktion zu vermindern.
Chronische Phase
- Bei wiederholten oder unvollständig resorbierten Embolien kann es zu einer chronischen thromboembolischen pulmonalen Hypertonie (CTEPH) kommen.
- Dies führt langfristig zu einer progressiven Rechtsherzinsuffizienz und pulmonaler Hypertonie.
Klinische Präsentation (Symptome)
Die klinische Präsentation einer Lungenembolie (LE) kann stark variieren, abhängig von der Größe des Embolus, der Anzahl der betroffenen Lungenarterien, dem allgemeinen Gesundheitszustand des Patienten und der zugrunde liegenden Ursachen. Eine präzise und schnelle klinische Beurteilung ist entscheidend für die frühzeitige Diagnose und Behandlung.
Allgemeine Symptome
Die Symptome einer Lungenembolie sind oft unspezifisch und können in ihrer Intensität variieren. Zu den häufigsten Symptomen gehören:
- Dyspnoe (Atemnot)
➜ Plötzlich einsetzende oder sich allmählich verschlimmernde Atemnot ist das häufigste Symptom.
➜ Kann bei körperlicher Anstrengung oder in Ruhe auftreten. - Thoraxschmerzen
➜ Häufig pleuritische Schmerzen (stechend, verstärkt durch Atmung oder Husten)
➜ Schmerzen können auch diffus und unspezifisch sein, besonders bei massiven Embolien. - Hämoptyse
➜ Husten von blutigem oder blutgestreiftem Sputum.
➜ Tritt weniger häufig auf, kann jedoch bei großen Embolien oder bei Infarktpneumonie beobachtet werden. - Synkope (Bewusstseinsverlust)
➜ Plötzliche Ohnmacht kann auf eine schwere hämodynamische Instabilität hinweisen.
➜ Häufiger bei massiven Embolien. - Tachykardie
➜ Erhöhte Herzfrequenz als kompensatorische Reaktion auf die verminderte Sauerstoffversorgung und den erhöhten pulmonalen Gefäßwiderstand. - Tachypnoe
➜ Erhöhte Atemfrequenz, oft ein frühes Zeichen. - Hypotonie
➜ Niedriger Blutdruck, besonders bei massiven Embolien, als Folge eines kardiogenen Schocks oder Rechtsherzversagens.
Spezifische klinische Zeichen
- Zyanose
➜ Bläuliche Verfärbung der Haut und Schleimhäute aufgrund von Hypoxämie.
➜ Häufiger bei schweren Fällen. - Jugularvenenstauung
➜ Sichtbare Stauung der Halsvenen als Zeichen einer Rechtsherzinsuffizienz. - Hepatomegalie
➜ Vergrößerung der Leber durch Blutstauung im rechten Herzvorhof, besonders bei chronischen oder wiederholten Embolien. - Pleuraerguss
➜ Ansammlung von Flüssigkeit im Pleuraspalt, manchmal blutig, kann bei großer Embolie auftreten.
Diagnostik
Die Diagnose der Lungenembolie (LE) erfordert eine systematische Vorgehensweise, die klinische Beurteilung, bildgebende Verfahren und Laboruntersuchungen umfasst. Eine schnelle und präzise Diagnose ist entscheidend, um die geeignete Therapie rechtzeitig einzuleiten und Komplikationen zu vermeiden.
Klinische Beurteilung
Anamnese und körperliche Untersuchung:
- Symptome
➜ Plötzlich einsetzende Dyspnoe, pleuritische Brustschmerzen, Hämoptyse, Synkope. - Klinische Zeichen
➜ Tachykardie, Tachypnoe, Hypotonie, Zyanose, Jugularvenenstauung.
Risikofaktoren
- Venöse Thromboembolie in der Anamnese
➜ Vorherige tiefe Venenthrombose (TVT) oder LE. - Immobilisation
➜ Längere Bettruhe, postoperative Zustände, lange Reisen. - Malignome
➜ Erhöhte Thromboseneigung bei Krebspatienten. - Hormonelle Einflüsse
➜ Schwangerschaft, orale Kontrazeptiva, Hormonersatztherapie.
Klinische Scores zur Risikoeinschätzung
- Wells-Score
➜ Ein häufig verwendetes Instrument zur Abschätzung der Vortestwahrscheinlichkeit einer LE. Punkte werden basierend auf klinischen Kriterien vergeben. - Revised Geneva Score
➜ Ein alternatives Scoring-System zur Beurteilung der Vortestwahrscheinlichkeit.
Laboruntersuchungen
D-Dimer-Test
- Sensitivität
➜ Hohe Sensitivität zur Ausschlussdiagnostik bei niedriger bis mittlerer klinischer Wahrscheinlichkeit. - Spezifität
➜ Niedrige Spezifität, da erhöhte D-Dimer-Werte auch bei anderen Zuständen wie Infektionen, Entzündungen oder nach Operationen auftreten können.
Arterielle Blutgasanalyse
- Hypoxämie und Hypokapnie
➜ Niedriger Sauerstoffgehalt und niedriger Kohlendioxidgehalt im Blut. - Alveoläre-arterielle Sauerstoffdifferenz
➜ Erhöht bei einer Lungenembolie.
Herzenzyme und BNP
- Troponin und BNP
➜ Erhöhte Werte können auf eine Rechtsherzbelastung hinweisen.
Bildgebende Verfahren
CT-Angiographie der Lunge (CTPA)
- Goldstandard
➜ Hauptdiagnosewerkzeug zur Bestätigung einer LE. - Vorteile
➜ Schnelle Durchführung, hohe Genauigkeit, zeigt direkt den Thrombus in den Lungenarterien.
Ventilations-Perfusions-Szintigraphie (V/Q-Scan)
- Alternative zur CTPA
➜ Besonders bei Patienten mit Kontraindikationen für Kontrastmittel. - Vorteile
➜ Hohe Sensitivität bei normalem Ergebnis, zeigt Ventilations-Perfusions-Missverhältnisse.
Echokardiographie (EKG)
- Rechtsherzbelastung
➜ Indirekte Hinweise auf LE durch Zeichen einer rechtsventrikulären Dysfunktion. - Notfall-Echokardiographie
➜ Nützlich bei hämodynamisch instabilen Patienten.
Duplex-Sonographie der Beinvenen
- Nachweis von TVT
➜ Hilfreich zur Bestätigung der Thrombosequelle bei Verdacht auf LE.
Röntgen-Thorax
- Ausschluss anderer Ursachen
➜ Hilfreich, um andere Differenzialdiagnosen wie Pneumothorax oder Pneumonie auszuschließen. - Indirekte Zeichen
➜ Westermark-Zeichen, Hamptons Hump, allerdings unspezifisch.
Weitere diagnostische Tests
Pulmonale Angiographie
- Früher Goldstandard
➜ Invasive Methode, heute durch CTPA weitgehend ersetzt. - Indikationen
➜ Komplexe Fälle oder bei unklaren Befunden trotz anderer Bildgebungen.
Magnetresonanzangiographie (MRA)
- Alternative Methode
➜ Selten verwendet, bietet Vorteile bei Patienten mit Kontraindikationen gegen Jod-haltige Kontrastmittel.
Differenzialdiagnostik
Die Symptome der Lungenembolie können viele andere Erkrankungen imitieren, was die Diagnose erschwert. Differenzialdiagnosen umfassen:
- Myokardinfarkt
➜ Ähnliche Brustschmerzen und Dyspnoe.
➜ Unterschiedliche EKG-Veränderungen und Troponinwerte helfen bei der Unterscheidung. - Pneumothorax
➜ Plötzlich einsetzende pleuritische Schmerzen und Dyspnoe.
➜ Abweichende Atemgeräusche und Thorax-Röntgenbefunde. - Pneumonie
➜ Fieber, produktiver Husten und pleuritische Schmerzen.
➜ Radiologische Befunde helfen bei der Unterscheidung. - Herzinsuffizienz
➜ Dyspnoe und Ödeme.
➜ Röntgen und Echokardiographie zur Differenzierung notwendig. - Rippenfraktur:
➜ Pleuritische Schmerzen, oft nach Trauma.
➜ Röntgenbefunde und klinische Geschichte helfen bei der Diagnose.
Therapie
Die Behandlung der Lungenembolie (LE) zielt darauf ab, die Thrombuslast zu reduzieren, die Hämodynamik zu stabilisieren und das Risiko für Rezidive und Komplikationen zu minimieren. Die Therapie wird nach dem Schweregrad der Lungenembolie und dem klinischen Zustand des Patienten angepasst.
Behandlung
- Initiale Behandlung
➜ Sauerstofftherapie (bei Hypoxämie zur Aufrechterhaltung der Sauerstoffsättigung)
➜ Intravenöse Flüssigkeitszufuhr (zur Unterstützung des Blutdrucks bei Hypotonie)
➜ Monitoring (Herz-Kreislauf-Überwachung auf einer Intensivstation bei schwerer LE) - Antikoagulation
➜ Initialtherapie mit niedermolekularem Heparin (LMWH), unfraktioniertem Heparin oder Fondaparinux.
➜ Langzeittherapie mit oralen Antikoagulanzien wie Warfarin oder direkten oralen Antikoagulanzien (DOAKs) wie Apixaban, Rivaroxaban. - Thrombolyse
➜ Indiziert bei hämodynamisch instabilen Patienten (massive Lungenembolie) mittels Alteplase (t-PA). - Chirurgische oder katheterbasierte Embolektomie
➜ Mechanische Entfernung des Thrombus bei Kontraindikationen gegen Thrombolyse oder bei Versagen der konservativen Therapie (z.B. chirurgische Embolektomie, katheterbasierte Thrombektomie) - Filter in der Vena cava inferior
➜ Präventiv bei wiederkehrenden Embolien trotz Antikoagulation oder Kontraindikationen gegen Antikoagulation. - Langzeitmanagement und Sekundärprävention
➜ Antikoagulation (bei hohem Rezidivrisiko oder persistierenden Risikofaktoren)
➜ Kompressionstherapie (Prävention postthrombotischer Syndrome bei Patienten mit TVT)
➜ Lebensstilmodifikation (Gewichtsreduktion, regelmäßige körperliche Aktivität, Vermeidung von Rauchen, Management von kardiovaskulären Risikofaktoren.)
Prävention
Die Primärprävention von Lungenembolien umfasst Maßnahmen zur Reduktion von Risikofaktoren und zur Prophylaxe von tiefen Venenthrombosen:
- Pharmakologische Prophylaxe
➜ Heparin, Fondaparinux oder DOAKs bei Risikopatienten (z.B. nach chirurgischen Eingriffen). - Mechanische Prophylaxe
➜ Verwendung von Kompressionsstrümpfen oder intermittierenden pneumatischen Kompressionsgeräten. - Frühmobilisation
➜ Postoperative Mobilisation und Bewegungsübungen zur Verbesserung der venösen Rückfluss.
Pflege bei Lungenembolie
Die Pflege bei einer Lungenembolie erfordert eine umfassende und gut koordinierte Anstrengung von medizinischem Personal, Patienten und deren Familien. Durch frühzeitige Erkennung, effektive Behandlung und konsequente Präventionsmaßnahmen können die Prognose verbessert und das Risiko von Komplikationen erheblich reduziert werden. Ein integrierter Ansatz, der sowohl die medizinischen als auch die psychosozialen Bedürfnisse des Patienten berücksichtigt, ist entscheidend für eine erfolgreiche Genesung und ein langfristig gesundes Leben.
Zusammenfassung
Die Lungenembolie (LE) ist eine ernste, potenziell tödliche Erkrankung, die durch den Verschluss einer oder mehrerer Lungenarterien durch ein Blutgerinnsel, meist aus einer tiefen Venenthrombose, verursacht wird. Symptome umfassen plötzliche Atemnot, Brustschmerzen und Husten mit blutigem Sputum. Die Diagnose erfolgt durch klinische Beurteilung, D-Dimer-Test und bildgebende Verfahren wie CT-Angiographie. Die Behandlung umfasst Antikoagulation, Thrombolyse bei schweren Fällen und präventive Maßnahmen wie Heparin und mechanische Prophylaxe. Eine schnelle Diagnose und Therapie sind entscheidend für die Prognose.
Bei diesem Artikel handelt es sich um ein Gesundheitsthema. Er dient weder der Selbstdiagnose noch ersetzt er eine Diagnose durch einen Arzt. Bitte zusätzlich den Hinweis zu Gesundheitsthemen beachten!
Quellen
- Faller, A., & Schünke, M. (2016). Der Körper des Menschen: Einführung in Bau und Funktion (A. Faller & M. Schünke, Hrsg.; 17. Aufl.). Thieme.
- Andreae, S. (Hrsg.). (2008). Lexikon der Krankheiten und Untersuchungen (2. Aufl.). Thieme.
- Goldhaber, S.Z. and Bounameaux, H., 2012. Pulmonary embolism and deep vein thrombosis. The Lancet, 379(9828), pp.1835-1846.
- Raskob, G.E., Angchaisuksiri, P., Blanco, A.N., Buller, H., Gallus, A., Hunt, B.J., Hylek, E.M., Kakkar, A., Konstantinides, S.V., McCumber, M. and Ozaki, Y., 2014. Thrombosis: a major contributor to global disease burden. Seminars in Thrombosis and Hemostasis, 40(07), pp.724-735.
- Tapson, V.F., 2008. Acute pulmonary embolism. New England Journal of Medicine, 358(10), pp.1037-1052.
- Konstantinides, S.V. and Torbicki, A., 2020. Management of venous thromboembolism: an update. European Heart Journal, 41(6), pp.596-603.
- Miniati, M., Monti, S., Pratali, L., Di Ricco, G. and Marini, C., 2012. Clinical presentation of acute pulmonary embolism: survey of 800 cases. PLoS One, 7(2), p.e30891.
- Stein, P.D., Beemath, A., Matta, F., Weg, J.G., Yusen, R.D., Hales, C.A., Hull, R.D., Leeper, K.V., Sostman, H.D., Tapson, V.F. and Buckley, J.D., 2007. Clinical characteristics of patients with acute pulmonary embolism: data from PIOPED II. The American Journal of Medicine, 120(10), pp.871-879.
- Wells, P.S., Anderson, D.R., Rodger, M., Ginsberg, J.S., Kearon, C., Gent, M., Turpie, A.G., Bormanis, J., Weitz, J.I., Chamberlain, M. and Bowie, D., 2000. Derivation of a simple clinical model to categorize patients‘ probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer. Thrombosis and Haemostasis, 83(3), pp.416-420.
- Moores, L.K., Jackson, W.L., Shorr, A.F. and Jackson, J.L., 2004. Meta-analysis: outcomes in patients with suspected pulmonary embolism managed with computed tomographic pulmonary angiography. Annals of Internal Medicine, 141(11), pp.866-874.
- Kearon, C., Akl, E.A., Ornelas, J., Blaivas, A., Jimenez, D., Bounameaux, H., Huisman, M., King, C.S., Morris, T.A., Sood, N. and Stevens, S.M., 2016. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest, 149(2), pp.315-352.
- Konstantinides, S.V., Meyer, G., Becattini, C., Bueno, H., Geersing, G.J., Harjola, V.P., Huisman, M.V., Humbert, M., Jennings, C.S., Jimenez, D. and Kucher, N., 2020. ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). European Heart Journal, 41(4), pp.543-603.
- Geerts, W.H., Pineo, G.F., Heit, J.A., Bergqvist, D., Lassen, M.R., Colwell, C.W. and Ray, J.G., 2004. Prevention of venous thromboembolism: the seventh ACCP conference on antithrombotic and thrombolytic therapy. Chest, 126(3), pp.338S-400S.
- Gould, M.K., Garcia, D.A., Wren, S.M., Karanicolas, P.J., Arcelus, J.I., Heit, J.A. and Samama, C.M., 2012. Prevention of VTE in nonorthopedic surgical patients: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest, 141(2_suppl), pp.e227S-e277S.